Ковалентная связь – это связь между двумя атомами за счет образования общей электронной пары.
Ковалентная неполярная связь – эта связь между атомами с равной
электроотрицательностью. Например: Н 2 , О 2 , N 2 , Cl 2 и т. д. Дипольный момент таких связей равен нулю.
Ковалентная полярная связь – эта связь между атомами с различной электроотрицательностью. Зона перекрывания электронных облаков смещается в сторону более электроотрицательного атома.
Например, Н–Cl (Н б+ →Cl б–).
Ковалентная связь обладает свойствами:
- насыщаемости – способности атома образовывать количество химических связей, соответствующих его валентности;
- направленности – перекрытие электронных облаков происходит в направлении обеспечивающем максимальную плотность перекрытия.
Ионная связь – это связь между противоположно заряженными ионами. Её можно рассматривать как крайний случай ковалентной полярной связи. Такая связь возникает при большой разнице электроотрицательностей атомов,
образующих химическую связь. Например, в молекуле NaF разница
электроотрицательностей составляет 4,0 – 0,93 = 3,07, что приводит к практически полному переходу электрона от натрия к фтору:
Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщаемости. В силу этого иoннaя связь не обладает направленностью и насыщаемостью.
Металлическая связь – это связь положительно заряженных ионов металла со свободными электронами .
Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло- и электропроводность. Это является следствием образования между атомами металлов особого вида связи – металлической связи.
У атомов металлов валентные электроны слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы металла и «свободные» электроны, электростатическое взаимодействие которых обеспечивает химическую связь.
Водородная связь – это связь посредством атома водорода, связанного с высокоэлектроотрицательным элементом .
Атом водорода, связанный с высокоэлектроотрицательным элементом (фтором, кислородом, азотом и др.), отдает практически полностью электрон с валентной орбитали. Образовавшаяся свободная орбиталь может взаимодействовать с неподеленной парой электронов другого электроотрицательного атома, в результате возникает водородная связь. На примере молекул воды и уксусной кислоты водородная связь показана штриховыми линиями:
Эта связь значительно слабее других химических связей (энергия ее образования 10÷40 кДж/моль). Водородные связи могут возникать как между различными молекулами, так и внутри молекулы.
Исключительно важную роль водородная связь играет в таких неорганических веществах, как вода, плавиковая кислота, аммиак и т.д., а также в биологических макромолекулах.
Связь в предложении - это способ придания предложению осмысленности, законченности мысли, а также логической, лексической и синтаксической полноценности. Существует два вида связи в предложении - сочинительная и подчинительная.
Сочинительная связь в предложении - это соединение не зависящих друг от друга элементов в предложении: однородных членов в простом или простых предложений в составе сложносочинённого.
Подчинительная связь в предложении - это соединение зависящих друг от друга элементов: слов в словосочетании, предложении или простых предложений в составе сложноподчинённого.
Как определить вид связи в предложении?
Прежде всего, необходимо отбросить грамматическую основу, так как подлежащее всегда связано со сказуемым, также стоит исключить вводные слова.
Пример. Мне хотелось выйти наружу, но дверь была заперта.
Сложное предложение с двумя независимыми частями, сложносочиненное. Исходя из этого, в данном предложении используется сочинительный вид связи .
Мне хотелось выйти наружу, потому что в комнате был очень спёртый воздух.
Сложное предложение, в котором наблюдается подчинительная связь - одно предложение указывает на причину того, о чём говорится в другом. Предложение сложноподчинённое.
Виды подчинительной связи.
Существует три вида подчинительной связи :
Согласование - это такой вид связи, когда зависимое и главное слово (существительное или другая часть речи в роли существительного) уподобляются друг другу в роде, числе и падеже. Самые простые примеры согласования - в словосочетаниях: мерзкий дождь, весёлая я, невидимый кто-то, случайный прохожий, гулкое «зй».
В качестве зависимых слов
при согласовании могут выступать любые изменяемые части речи: прилагательные , местоимения (притяжательные, определительные, указательные, отрицательные, неопределённые) и порядковые числительные.
Никаких денег, веселому рассказчику, вашей сестры, первому встречному.
Управление
- вид связи, при котором главное слово
требует особой формы падежа зависимого слова. Падежная форма
при этом обусловлена определенными морфологическими нормами в русском языке . Главным признаком наличия управления в словосочетании или предложении является использование предлога , хотя бывает и беспредложная форма управления. При наличии управления зависимое слово всегда будет отвечать на вопросы косвенных падежей.
Смотреть на луну, любоваться луной, расписаться в получении, подписать документы, забыть о проблемах, забыть формулу.
Ооочень Н-А-Д-О, Как определить вид хим. связи? Желательно простым языком...) и получил лучший ответ
Ответ от Петрос[гуру]
Два одинаковых неметалла-ковал. неполярная (H-H, Cl-Cl).
Два разных -- Ков.полярная (H-Cl,C=O); металл и неметалл -- ионная (К-Cl).
В металлах (в куске Ме) - металлическая.
Ответ от Ѐамазан Курбанов
[новичек]
химия 8 класс
Ответ от Инга Филиппова
[активный]
Ковалентная связь – это химическая связь, которая возникает между атомами неметаллов. Ковалентная связь может быть полярной – если она образуется между атомами неметаллов одного вида, или неполярной – если образуется между атомами неметаллов разных видов.
Если вещество сложное, и все атомы, в него входящие – неметаллы, то это будет ковалентная неполярная связь.
Если все атомы вещества – металлы, вне зависимости от того, простое это вещество или сложное, то связь будет МЕТАЛЛИЧЕСКАЯ.
Если вещество сложное и в нем присутствуют как атомы металлов, так и атомы неметаллов, то возникает ИОННАЯ связь – связь между атомами разных видов.
На этом у меня все.
Ответ от Евгений Терентьев
[мастер]
Ковалентная связь (от лат. co - «совместно» и vales - «имеющий силу») - химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году . Этот термин относился к химической связи, обусловленной совместным обладанием электронами, в отличие от металлической связи, в которой электроны были свободными, или от ионной связи, в которой один из атомов отдавал электрон и становился катионом, а другой атом принимал электрон и становился анионом.
Позднее (1927 год) Ф. Лондон и В. Гайтлер на примере молекулы водорода дали первое описание ковалентной связи с точки зрения квантовой механики.
С учётом статистической интерпретации волновой функции М. Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис. 1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (A):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона .
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные - двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные - двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Ответ от Динара Зарипова
[гуру]
Есть 4 вида хим. связей (может и больше, но рассмотрим самые распространённые)
1) ковалентная - связь между НЕМЕТАЛЛАМИ
а) неполярная - между атомами одного хим. элемента (О2)
б) полярная - между атомами разных хим. элементов (HCl)
2) ионная - между металлами и неметаллами
3) металлическая - между МЕТАЛЛАМИ
4) водородная (орган. хим.) - занимает особое место среди всех типов химических связей. Она обеспечивается атомом водорода, расположенным между двумя электроотрицательными ионами (например, атомами кислорода)
Ответ от Алия Есенбаева
[гуру]
Есть ионная, ковалентная (полярнаяи неполярная)... Ионная-это МЕТАЛЛ+НЕМЕТАЛЛ, ну например Слав---NA+CL....Ковалентная---Неметалл+неметалл... есть 2 вида как я уже сказала ковалентной связи-полярная-это когда в соединение 2 разных элемента (Неметалла) например H+Cl,а неполярная-это практически всегда простые вещества, например Cl2.F2.O2 ну и так далее)) У меня по химии 4,но связь у меня 5))Обращайся)) Удачи Славик)) Пиши в агент, если не понял))
Ответ от Ђатьяна Иванова
[гуру]
Про металлическую связь всё верно: это связь между атомами в кристалле металла.
Что касается ковалентной (неполярной и полярной) и ионной связи - тут тип связи определяется разностью электроотрицательностей элементов (значение электроотрицательности можно посмотреть по таблице или шкале электроотрицательности в справочнике; она есть в некоторых учебниках) :
- если разность электроотрицательности равна 0, то связь КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ - между атомами одного элемента-неметалла (Cl2, H2, O2, P4, между атомами углерода в графите и алмазе...) ;
- если разность электроотрицательности от 0 до 2 (не включая 0 и 2), то связь КОВАЛЕНТНАЯ ПОЛЯРНАЯ - между атомами разных неметаллов (например, Н2О, PCl5, СS2), а также в ряде соединений металлов с неметаллами (например, оксид германия GeO2 - разность электроотрицательности равна 3,50 - 2,02 = 1,48; силицид магния Mg2Si - разность электроотрицательности равна 2,25 - 1,23 = 1,02);
- если разность электроотрицательности больше или равна 2, то связь ИОННАЯ - это связь между металлами и неметаллами, находящимися в таблице Менделеева далеко друг от друга (металлы 1 и 2 групп и неметаллы 6 и 7 групп, например: оксид кальция СаО - разность электроотрицательности равна 3,50 - 0,86 = 2,64; фторид калия KF- разность электроотрицательности равна 4,10 - 0,91 = 3,19).
Таким образом, ковалентную полярную связь можно рассматривать как переходную между ковалентной неполярной и ионной связью. Четкой границы между ионной и ковалентной полярной связью нет, т. к. механизм образования ковалентной и ионной связи одинаков, ионная связь - это крайняя степень ковалентной полярной связи.
Итак, при определении типа связи руководствуйтесь предыдущими ответами, но если надо уточнить тип связи между металлом и неметаллом (эта связь не всегда ионная!) , - то пользуйтесь шкалой электроотрицательности.
Фундаментальной основой химической связи явилась теория химического строения А. М. Бутлерова (1861 г.), согласно которой свойства соединений зависят от природы и числа составляющих их частиц и химического строения. Эта теория нашла подтверждение не только для органических, но и неорганических веществ, поэтому ее следует считать фундаментальной теорией химии.
Понятие химической связи
Большинство простых веществ и все сложные вещества (соединения) состоят из атомов, определенным образом взаимодействующих друг с другом. Иными словами, между атомами устанавливается химическая связь.
Химическая связь - электронный феномен, заключающийся в том, что, по крайней мере, один электрон, находившийся в силовом поле своего ядра, оказывается в силовом поле другого ядра или нескольких ядер одновременно. При образовании химической связи энергия всегда выделяется, т.е. энергия образующейся частицы должна быть меньше суммарной энергии исходных частиц.
Под химической связью понимаются различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллических и иных веществ.
К основным чертам химической связи можно отнести:
- снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована;
- перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
По своей природе химическая связь представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом.
Переход электрона от одного атома к другому, в результате чего образуются разноименно заряженные ионы с устойчивыми электронными конфигурациями, между которыми устанавливается электростатическое притяжение, является простейшей моделью ионной связи:
X ⇒ X + + e - Y + e - ⇒ Y - X + Y -
Параметры химической связи
Химическая связь осуществляется s- и p -электронами внешнего и d- электронами предвнешнего слоя. Эта связь характеризуется следующими параметрами:
- Длиной связи - межъядерным расстоянием между двумя химически связанными атомами.
- Валентным углом - углом между воображаемыми линиями, проходящими через центры химически связанных атомов.
- Энергией связи - количеством энергии, затрачиваемой на ее разрыв в газообразном состоянии.
- Кратностью связи - числом электронных пар, посредством которых осуществляется химическая связь между атомами.

Если мы будем сближать два протона, то между ними возникнут силы отталкивания, и о получении устойчивой системы говорить не приходится. Поместим в их поле один электрон. Здесь могут возникнуть два случая.
Первый, когда электрон находится между протонами (слева), и второй, когда он располагается за одним из них (справа).
В обоих случаях возникают силы притяжения. В первом случае составляющие этих сил (проекции) на ось, проходящую через центры протонов, направлены в противоположные стороны с силами отталкивания (слева) и могут их компенсировать. При этом возникает энергетически устойчивая система. Во втором случае составляющие сил притяжения направлены в разные стороны (справа) и трудно говорить об уравновешивании сил отталкивания между протонами. Отсюда следует, что для возникновения химической связи с образованием молекулы или иона электроны должны находиться преимущественно в межьядерном пространстве. Эта область называется связывающей , т.к. при нахождении там электронов образуется химическая связь. Область, находящаяся за ядрами, называется разрыхляющей , т.к. при попадании в нее электронов химическая связь не образуется.
Применив аналогичные рассуждения к молекуле водорода, можно прийти к выводу, что появление второго электрона в связывающей области еще более стабилизирует систему. Следовательно, для образования устойчивой химической связи необходима, по меньшей мере, одна электронная пара. Спины электронов в этом случае должны быть антипараллельны, т.е. направлены в разные стороны. Образование химической связи должно сопровождаться понижением полной энергии системы.
Рассмотрим изменение потенциальной энергии системы на примере сближения двух атомов водорода. Когда атомы находятся на очень большом расстоянии друг от друга, они не взаимодействуют и энергия такой системы близка к нулю. По мере их сближения возникают силы притяжения между электроном одного атома и ядром другого и наоборот. Эти силы увеличиваются обратно пропорционально квадрату расстояния между атомами. Энергия системы понижается. По мере сближения атомов начинают играть роль силы отталкивания между их ядрами и электронами. Увеличение сил отталкивания обратно пропорционально уже шестой степени расстояния. Кривая потенциальной энергии проходит через минимум, а затем резко уходит вверх.
Расстояние, соответствующее положению минимума на кривой, является равновесным межъядерным расстоянием и определяет длину химической связи. Так как атомы в молекуле участвуют в колебательном движении относительно положения равновесия, расстояние между ними постоянно меняется, т.е. атомы не жестко связаны друг с другом. Равновесное расстояние соответствует при данной температуре некоторому усредненному значению. С повышением температуры амплитуда колебания увеличивается. При какой-то достаточно большой температуре атомы могут разлететься на бесконечно большое расстояние друг от друга, что будет соответствовать разрыву химической связи. Глубина минимума по оси энергии определяет энергию химической связи, а величина этой энергии, взятая с обратным знаком, будет равна энергии диссоциации данной двухатомной частицы. Если сближаются атомы водорода, электроны которых имеют параллельные спины, между атомами возникают лишь силы отталкивания, а потенциальная энергия такой системы будет возрастать.
Количество энергии, выделяющееся при образовании химической связи, называется энергией химической связи Е св . Она имеет единицу измерения [кДж/моль]. Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Например, энергию связи в метане определяют путем деления энергии образования молекулы СН 4 из атомов водорода и углерода на четыре (1640: 4 = 410 кДж/моль). Чем больше энергия химической связи, тем устойчивее молекулы. Например, молекула HF устойчивее молекулы НВr .
Важной характеристикой химической связи является ее длина l св , равная расстоянию между ядрами в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и соответственно устойчивость молекул . Например, в ряду галогеноводородов от HF до HI длина связи растет, а ее энергия уменьшается.
Энергии и длины некоторых химических связей
| Связь | Е св
, кДж/моль |
l св
, нм |
Связь | Е св
, кДж/моль |
l св
, нм |
Связь | Е св
, кДж/моль |
l св
, нм |
Связь | Е св
, кДж/моль |
l св
, нм |
 |
536 | 0,092 |  |
348 | 0,154 |  |
432 | 0,128 |  |
614 | 0,134 |
 |
360 | 0,142 |  |
495 | 0,121 |  |
299 | 0,162 |  |
839 | 0,120 |
 |
436 | 0,074 |  |
1040 | 0,113 |  |
380 | 0,134 |  |
940 | 0,110 |
Виды химической связи


В образовании химической связи участвуют s- , р- и d -электроны, имеющие различную геометрическую конфигурацию электронных облаков и различные знаки волновых функций в пространстве. Для возникновения химической связи необходимо перекрывание частей электронных оболочек с одинаковым знаком волновой функции. В противном случае химическая связь не образуется. Это утверждение легко объяснить на примере наложения двух синусоид, которые в первом приближении могут отождествляться с волновыми функциями.
В случае наложения двух синусоид с разными знаками в одной и той же области (слева) суммарная составляющая их будет равна нулю - связи нет. В противоположном случае происходит сложение амплитуд колебаний и образуется новая синусоида - химическая связь образовалась (справа).
В зависимости от симметрии электронных облаков, в результате перекрывания которых образуется химическая связь, суммарное электронное облако будет иметь различную симметрию, в соответствии с которой они распадаются на три вида: σ -, π - и δ -связи.
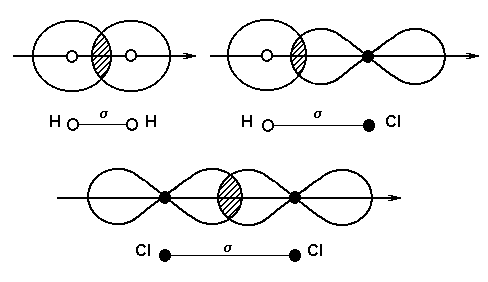
σ-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов, при этом максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов. В образовании σ -связи в силу своей шаровой симметрии всегда принимают участие s -электроны. Они образуют σ -связь в результате перекрывания со следующими электронами другого атома: s- , р х -, d x 2 -y 2 -электронами. С электронами, находящимися на других орбиталях, например, р у или р x , возникновение химической связи невозможно, так как происходит перекрывание в областях, где электронная плотность имеет противоположные знаки. Возможность образования σ -связи s -электронами не исчерпывается, она может образоваться в случае перекрывания и других электронных облаков, таких, как двух р х или р х и d x 2 -y 2 .

π-связи возникают при перекрывании электронных облаков над и под линией, соединяющей центры атомов. Суммарные электронные облака также симметрично расположены относительно этой оси, но они не имеют цилиндрической симметрии, как в случае σ -связи. В силу своего пространственного расположения π -связь образуют электроны на таких парах орбиталей как р y -р y ,р z -р z ,р y -d xy .
δ-связь образуют только d -электроны за счет перекрывания всех четырех своих лепестков электронных облаков, расположенных в параллельных плоскостях. Такое возможно, когда в образовании связи участвуют d xy -d xy , d xz -d xz , d yz -d yz -электроны.
Существует и другой подход к классификации химической связи, основанный на характере распределения электронной плотности между атомами в молекуле, т.е. химическая связь рассматривается с точки зрения принадлежности электронной пары тому или иному атому. Возможны три случая:
- Электронная пара связывает в молекуле два одинаковых атома. В этом случае она в равной мере принадлежит им обоим. В молекуле нет разделения центров тяжести положительного и отрицательного зарядов. Они совпадают, и такая связь называется ковалентной неполярной .
- Если электронная пара связывает два различных атома, то она смещается в сторону более электроотрицательного атома. Центры тяжести положительного и отрицательного зарядов разделяются, связь становится полярной и носит название ковалентной полярной связи .
- Третий случай связан с полной передачей электронной пары во владение одного из атомов. Это происходит при взаимодействии двух атомов, резко отличающихся по электроотрицательности, т.е. способности удерживать электронную пару в своем электрическом поле. При этом атом, отдавший электроны, становится положительно заряженным ионом, а атом, принявший их,- отрицательным. В этом случае связь носит название ионной .
Химическая связь – это сила, удерживающая друг с другом частицы, образующие вещество.
В зависимости от частиц, которые удерживают эти силы, связи подразделяются на внутримолекулярные и межмолекулярные.
Внутримолекулярные связи.
- Ковалентная связь.
Ковалентная связь – это общая электронная пара у двух атомов неметаллов.
Рассмотрим на примере молекулы водорода (Н 2), в которой как раз реализуется ковалентная связь.
Молекулы водорода состоит из двух атомов водорода (Н), у которых на внешнем энергетическом уровне один электрон:
Атомы стремятся полностью заполнить свои орбитали. Для этого и объединяются два атома. Они делают свои неспаренные электроны общими: и получается общая электронная пара. Электроны стали спаренными:

Эта общая электронная пара и есть ковалентная химическая связь. Ковалентная связь обозначается либо чертой, соединяющей атомы, либо двумя точками, которые обозначают общую электронную пару:
![]()
Представьте, что есть два соседа по парте. Это два атома. Им нужно нарисовать картинку, в которой есть красный и синий цвет. У них есть общая пара карандашей (один красный, другой синий) – это общая электронная пара. Оба соседа по парте пользуются этими карандашами. Таким образом эти два соседа связаны общей парой карандашей, т.е. ковалентной химической связью.
Существует два механизма образования ковалентной химической связи.
- Обменный механизм образования ковалентной связи.
В таком случае каждый атом предоставляет электроны для образования ковалентной связи. Этот механизм мы и рассмотрели, когда знакомились с ковалентной связью:

- Донорно-акцепторный механизм образования ковалентной связи.
В этом случае общая электронная пара, если можно так выразиться, неравноценная.
Один атом имеет НЭП – неподеленную электронную пару (два электрона на одной орбитали). И он предоставляет ее целиком для образования ковалентной связи. Этот атом называется донором – поскольку он предоставляет оба электрона для образования химической связи.
А второй атом имеет только свободную орбиталь. Он принимает электронную пару. Этот атом называется акцептором – он принимает оба электрона.

Классический пример – это образование иона аммония NH 4 + . Он образуется при взаимодействии иона H + и аммиака (NH 3). Катион водорода H + – это пустая s-орбиталь.

Эта частица будет акцептором.
У тома азота в аммиаке есть НЭП (неподеленная электронная пара).

Атом азота в аммиаке будет донором:

В данном случае и синий и красный карандаш принес один сосед по парте. Он «угощает» второго. И они оба пользуются карандашами.
Конкретные реакции, в которых образуется такой ион, будут рассмотрены позже в соответствующих разделах. Пока вам просто нужно запомнить принцип, по которому образуется ковалентная связь по донорно-акцепторному механизму.
Ковалентная связь бывает двух видов. Различают ковалентную полярную и неполярную связи.
Ковалентная полярная связь возникает между атомами неметаллов с разными значениями электроотрицательности. То есть между разными атомами неметаллов.
Атом с большим значением электроотрицательности будет оттягивать общую электронную пару на себя.

Ковалентная неполярная связь возникает между атомами неметаллов с одинаковыми значениями электроотрицательности. Такое условие выполняется, если связь возникает между атомами одного химического элемента-неметалла . Поскольку у разных атомов электроотрицательности могут быть очень близкими друг к другу, но все равно будут отличаться.
Общая электронная пара не будет смещаться ни к одному атому, так как каждый атом «тянет» ее с одинаковой силой: общая электронная пара будет находиться посередине.

И конечно же ковалентная связь может быть одинарной, двойной и тройной:
- Ионная связь.
Ионная связь возникает между атомами металла и неметалла. Поскольку у металла и неметалла большая разница в электроотрицательности, электронная пара полностью оттягивается к более электроотрицательному атому – атому неметалла.
Конфигурация полностью заполненного энергетического уровня, достигается не за счет образования общей электронной пары. Неметалл забирает себе электрон металла – заполняет свой внешний уровень. А металлу проще отдать свои электроны (у него их немного) и у него тоже полностью заполненный уровень.

Таким образом металл, отдав электроны, приобретает отрицательный заряд, становится катионом. А неметалл, получив электроны, приобретает отрицательный заря, становится анионом.
Ионная химическая связь представляет собой электростатическое притяжение катиона к аниону .

Ионная связь имеет место в солях, оксидах и гидроксидах металлов. И в других веществах, в которых атом металла связан с атомом неметалла (Li 3 N, CaH 2).
Здесь следует обратить внимание на одну важную особенность: ионная связь имеет место между катионом и анионов во всех солях . Наиболее общим образом мы описываем как связь металл-неметалл. Но необходимо понимать, что это сделано лишь для упрощения. В составе соли может и не быть атома металла. Например, в солях аммония (NH 4 Cl, (NH 4) 2 SO 4 . Ион аммония NH 4 + притягивается к аниону соли – это ионная связь.
Откровенно говоря, нет никакой ионной связи. Ионная связь – это всего лишь крайняя степень ковалентной полярной связи. У любой связи есть свой процент «ионности» – это зависит от разности электроотрицательностей. Но в школьной программе, а тем более в требованиях ЕГЭ ионная и ковалентная связь – это совершенно два разных понятия, которые нельзя смешивать.
- Металлическая связь.
Все великолепие металлической связи можно понять лишь вместе с металлической кристаллической решеткой. Поэтому металлическую связь мы рассмотрим позже, когда будем разбирать кристаллические решетки.
Все, что пока нужно знать – это то, что металлическая связь реализуется в простых веществах – металлах.

Межмолекулярные связи.
Межмолекулярные связи гораздо слабее внутримолекулярных, так как в них не замешана общая электронная пара.
- Водородные связи .
Водородные связи возникают в вещества, в которых атом водорода связан с атомом с высоким значением электроотрицательности (F, O, Cl, N).
В таком случае связь с атомов водорода становится сильнополярной. Электронная пара смещается от атома водорода к более электроотрицательному атому. Из-за этого смещения, на водороде появляется частичный положительный заряд (δ+), а на электроотрицательном атоме частичный отрицательный заряд (δ-).
Например, в молекуле фтороводорода:
К δ+ одной молекулы притягивается δ- другой молекулы. Это и есть водородная связь. Графически на схеме она обозначается пунктирной линией:
![]()
Молекула воды может образовывать четыре водородные связи:

Водородные связи обусловливают более низкие температуры кипения и плавления веществ, между молекулами которых они возникают. Сравните сероводород и воду. В воде есть водородные связи – она жидкость при нормальных условиях, а сероводород – газ.
- Силы Ван-дер-Ваальса .
Это очень слабые межмолекулярные взаимодействия. Принцип возникновения такой же, как и у водородных связей. Очень слабые частичные заряды возникают при колебаниях общей электронной пары. И возникают сиюминутные силы притяжения между этими зарядами.